Práctica: 2
PREPARACIÓN Y
ESTERILIZACIÓN DE MATERIALES Y DE MEDIOS DE CULTIVO
Objetivo:
Aprender los medios de
cultivos básicos que existen en laboratorio al igual para que medio de efectúa
cada uno (aplicaciones), aprendiendo claramente que para tener un crecimiento
de colonias debemos esterilizar el material ya que debe ser realista el
antígeno que se va a estudiar ya que de este se deriva el diagnostico clínico.
Introducción:
La esterilización se
define como la destrucción completa de todos los microorganismos presentes
incluyendo las formas vegetativas y las esporas. Para lograr la destrucción de
las bacterias, existen diferentes medios como son: la acción de los agentes
químicos y antibióticos.
Los principales
métodos de esterilización empleados en el laboratorio de bacteriología son:
Calor húmedo, seco, y
filtración para los líquidos sin olvidar que cuando se requiere una
esterilización mas completa se efectúa esta usando gas (oxido de etileno) y el
área de trabajo se expone a los rayos ultravioleta.
Los microorganismos
estudiados en el laboratorio por lo regular son heterótrofos, ya que requieren
de compuestos complejos como fuentes de carbono y nitrógeno.
Los microorganismos
como otros seres vivos son susceptibles a los cambios de temperatura a medida
que se han podido a adaptar a estos cambios.
Uno de los sistemas más importantes para la
identificación de microorganismos es
observar su crecimiento en sustancias alimenticias artificiales paradas
en el laboratorio.
El material
alimenticio en el que crecen los microorganismos es el Medio de Cultivo y el crecimiento de los microorganismos es el Cultivo. Para que las bacterias
crezcan adecuadamente en un medio de cultivo artificial debe reunir una serie
de condiciones como son: temperatura, grado de humedad y presión de oxígeno
adecuado, así como un grado correcto de
acidez o alcalinidad.
El agar es un elemento
solidificante muy empleado para la preparación de medios de cultivo.
La materia prima que
se utiliza para estos medios son:
PEPTONAS.- son
moléculas que se obtienen de la degradación de las proteínas de origen vegetal
o animal las que presentan una fuente de nitrógeno en forma de proteínas
digeridas que son fácilmente asimilables por los microorganismos en crecimiento.
HIDROCARBUROS.- se
utilizan como fuente energética y permite ver reacciones del metabolismo de los
microorganismos (bioquímicas).
SALES.- como el
cloruro de sodio, mantiene la isotonicidad y forma soluciones amortiguadoras
(mantiene el equilibrio osmótico).
AGAR.- es un
polisacárido obtenido de las algas rodofíceas y proporciona un soporte al medio
de cultivo ya que es una agente solidificante.
CALDO NUTRITIVO O
BASE.- Es un medio básico a partir del cual se preparan otros muchos e
importantes medios, es un caldo elaborado con extracto de carne, contiene
además substancias extractivas solubles, sales y algo de carbohidratos
(dextrosa); pero poca proteína, la peptona que se agrega satisface la cantidad
de proteínas necesarias, la sal que se añade es para dar al caldo el mismo
contenido aproximado que tiene la sangre. A este medio se le puede agregar
sangre entera estéril la que enriquece al medio.
USOS: se emplea en cultivos primarios y en análisis de agua y además según
los ingredientes que se le agreguen sirve para gran variedad de propósitos,
ejemplo: estudio del metabolismo bacteriano.
|
Reactivos:
·
Agua destilada
·
Colorantes de Gram
·
fenol
|
·
Portaobjetos
·
Matraz
Erlenmeyer
·
Cajas
Petri
·
Algodón,
gasa, papel estraza
·
Cinta
testigo
·
Piseta
·
Cuba
·
Microscopio
·
Autoclave
·
Incubadora
·
Asa
de platino
·
tripie
·
Mechero
de bunsen y Fisher
Agares seleccionados en solución de 40 mL:
·
SS
(salmonella y shigella)
·
EMB
Muestras biológicas:
·
Heces
·
Orina
·
Mucosidad
vaginal
·
Mucosidad
faringea
Procedimiento:
1.
Lavar
perfectamente dos matraces con escobillón y detergente. Enjuagar con abundante
agua corriente.
2.
Pesar
con ayuda de una balanza la cantidad necesaria de medio de cultivo de agar EMB
y S.S. para una solución de 40 ml de agua. SS: 2.9 gr. EMB: 1.49gr.
3.
Elaborar
con algodón y gasa unos tapones para los matraces, que ajuste en estos, sobre
estos colocar un gorrito hecho con estraza.
4.
En un
matraz agregar 40ml de agua purificada.
5.
Limpiar
el área de trabajo con fenol para desinfectarla. Encender el mechero de Bunsen,
y colocar sobre este el tripie y encima la tela de asbesto.
6.
Agregar
el agar cual sea de los ya mencionados anteriormente al matraz, colocar este
último sobre la tela de asbesto y disolver calentado. Dejarlo hervir durante un
minuto.
7.
Cuando
se alcance el punto de ebullición, bajar el matraz del fuego, flamear el tapón
y la boca del matraz, para taparlo y colocarle el papel estraza. Repetir los
pasos 5-8 para el siguiente medio.
8.
Colocar
las cajas de Petri cerca del mechero, y verter en una de ellas el medio S.S.
hasta la ¾ partes. Esperar a que solidifique.
9.
Esterilizar
con autoclave solamente al medio EMB, de la siguiente manera:
·
En la
olla exprés verter agua hasta el nivel indicado (1/3 parte)
·
Colocar
la base dentro de esta y ponerla al fuego (con los mecheros Fisher)
·
Meter
los medios a la autoclave.
·
Cerrar
la olla y esperar a que la temperatura se eleve
·
Dejar
que se caliente hasta los 121°C o 15 libras de presión revisando continuamente
la escala del manómetro. Una vez alcanzada esta temperatura deberá bajarse el
nivel del fuego sacando y metiendo uno de los mecheros.
·
Mantener
así por 15 minutos.
·
Transcurridos
los 15 minutos. Apagar el fuego y dejar a que la presión descienda a 0.
·
Abrir
cuidadosamente la olla y sacar los medios ya esterilizados.
10. Dejar enfriar al
medio, hasta una temperatura en la que el matraz caliente pero no queme la
piel, y verter suavemente en la caja o cajas Petri el medio de cultivo.
11. Una vez que se
tienen solidificados los medios de cultivo, se procede a sembrar en ellos. Se
toma el asa, se flamea y se toma un poco de la muestra de heces, para hacer el
rayado de la placa en sectores, sembrando en ambos medios. Se flamea nuevamente
el asa y se procede a la misma operación pero con la orina.
Se dejan incubar en
la estufa de incubación por un lapso de 24-48 horas
Preparación de frotis:
1. Tiempo
transcurrido. Se sacan los medios de cultivo y se observan las colonias de
estos microorganismos estas se observan macroscópica como microscópicamente.
2.
Lavar
y secar perfectamente los portaobjetos.
3.
Limpiar
la mesa o lugar de trabajo con fenol.
4.
Prender
el mechero y esterilizar el asa en la flama del mechero hasta que se ponga al
rojo vivo.
5.
Dejar
enfriar el asa para evitar que al tomar la muestra los microorganismos sean
destruidos.
6.
Colocar
la muestra en el centro del portaobjetos, extender suavemente en un área
circular de 2 cm de diámetro aproximadamente o colocar en el centro del
portaobjetos una gota de agua destilada en la que se mezcla una pequeña muestra
del cultivo y esterilizar nuevamente el asa. Dejar secar el frotis al aire
7.
Fijar
los frotis
8.
Teñir
por tinción de Gram (cristal violeta 1min).
9.
Yodo
lugol 1min. Enjuagar con alcohol cetona.
10.
Poner
safranina 1min. Y enjuagar con agua corriente.
11.
Dejar
secar al aire y observar la preparación al microscopio localizando con el
objetivo 10x, pasar luego a 40x y observar a detalle con el objetivo 100x,
colocando previamente una gota de aceite de inmersión.
Resultados:
Medio S.S.
Cuando se
preparó este medio y se vacío a las cajas
Petri su
consistencia se pudo notar un poco de color rosa
Claro con
estado sólido.
Medio S.S (colonias)
En este medio se sembro mucosidad
vaginal y he aquí
Los resultados de sus colonias estas
se pueden observar
·
Puntiforme
·
Lisa
·
Elevada
Con un estado mucoide.
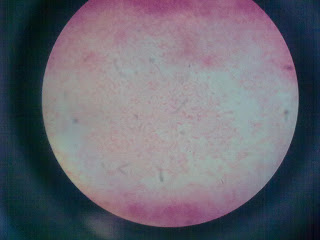
Vista microscópicamente agar S.S
Se observan estreptococos
gramnegativos.
Medio EMB
En la reparación de este medio
notábamos que su color
Era un poco verdoso pero a la vez con
un color violeta.
Medio EMB (colonias)
En este medio se sembró mucosidad
faríngea
Sus colonias no eran muy notorias ya
que viéndolas
Macroscópicamente algunos se podían
ver blanquecinos
Mucoides, puntiformes, planas con un
borde ondulado.
Vista microscópicamente de agar
EMB
Tinción diferencial
En esta podemos observar demasiados
bacilos
Con agrupaciones empalizados gramnegativos.
Observación:
Al hacer esta practica
se pudo hacer practica de conocimientos ya vistos previamente para hablar
un poco de todo para hacer el estudio
del comportamiento, como yo digo la personalidad de la bacteria invitro primero se debe hacer una esterilización de
material para efectuarse bien y para que no exista una contaminación y
observemos de otro microorganismo, se hace el medio de el procedimieto que se
necesite este. Cultivamos o sembramos el microorganismo de alguna muestra
biológica que se necesite diagnosticar algo dependiendo de que cuadro clínico
se sospeche por ejemplo: si se sospecha de E.coli la muestra necesaria seria de
heces fecales en un medio EMB ya que este esta enriquecido para que esta
batería se pueda desarrollar esta bacteria al igual que se pueda identificar
macroscópicamente y por lo tanto para hacer la identificación microscópica se
hace una tinción, en este caso nosotros hicimos una de gram esta se basa en
diferenciar las bacterias ya que se clasifican en negativas y positvas al igual
se estudia las agrupaciones, y morfología.
Conclusión:
El medio SS nos sirve para el
aislamiento de salmonellas y de Shigella de heces, de comestibles y de otros
materiales.
Las
enterobacterias pueden ser diferenciadas en base a su capacidad de fermentar la
lactosa . Las especies de Salmonella y Shigella son no fermentadoras de la
lactosa y forman colonias incoloras en el Agar SS. Las especies de Salmonella
que son productoras de sulfuro de hidrógeno desarrollan colonias con centro
obscuro.
Los
coloformes son parcialmente inhibidos. E. Coli produce colonias de color rosa a
rojo y pueden presentar una zona de precipitado. Las colonias de Enterobacter
aerogenes son cremosas de color rosa. Citrobacter y Proteus spp. Pueden crecer
produciendo colonias con centros de color gris o negro debido a la producción
de H2 S. Enterobacter faecalis es parcialmente inhibido presentando colonias
incoloras.
El medio EMB nos
sirve para Este medio (también denominado E.A.M.) es utilizado para el aislamiento
selectivo de bacilos Gram negativos de rápido desarrollo y escasas exigencias
nutricionales. Permite el desarrollo de todas las especies de la familia
Enterobacteriaceae.
Referencia:
·
Diagnostico
microbiológico-koneman/Allen/Janda/Sommers/Winn-editorial medica panamericana.
·
Métodos de labortaorio-M.J.Linch-nueva editorial
interamericana.
































No hay comentarios:
Publicar un comentario